华大在线讯(通讯员 钟书)12月10日,我校生命科学学院仝晶晶团队联合中国医学科学院阜外医院王志华团队,在国际期刊《Science Translational Medicine》在线发表题为“A hyperactive splice variant of STAT3 promotes colonic inflammation-associated tumorigenesis in mice”的研究成果。我校博士后徐梦、博士研究生韦定菊、钟书及武汉大学中南医院刘韦成主任医师为共同第一作者,仝晶晶为最后通讯作者,我校为第一完成单位。

慢性炎症向肿瘤转化是临床医学的重大难题,炎症性肠病(IBD)患者的结直肠癌(CRC)发病风险显著高于普通人群。STAT3作为JAK-STAT信号通路的核心分子,在该过程中扮演着“双刃剑”的角色。生理状态下维持肠道免疫平衡,慢性炎症刺激下则异常激活,驱动细胞失控癌变。然而,抑制STAT3全功能的治疗策略因极易诱发严重副作用,导致临床转化应用屡屡受阻,成为制约靶向STAT3对IBD与CRC精准治疗的关键瓶颈。
研究团队发现,STAT3的21号外显子存在一个隐含剪接位点,会选择性产生两种仅相差一个氨基酸(第701位丝氨酸,S701)的蛋白亚型——含S701的STAT3_wS701亚型与缺失S701的STAT3_ΔS701亚型。正是这一个氨基酸的“有无”,让STAT3的功能天壤之别:前者自带“分子刹车(S701)”,能避免炎症失控;后者则因缺失“刹车”,成为驱动结肠炎症-肿瘤转化的“超活跃加速器”。更为关键的是,目前临床与科研中广泛使用的“STAT3活化检测抗体”(针对Y705磷酸化),无法识别STAT3_ΔS701的活化状态。这意味着,过去许多患者体内STAT3的真实激活水平被严重低估,而这部分被忽视的“超活化”STAT3_ΔS701亚型,极有可能才是真正驱动疾病进展的“暗流”。
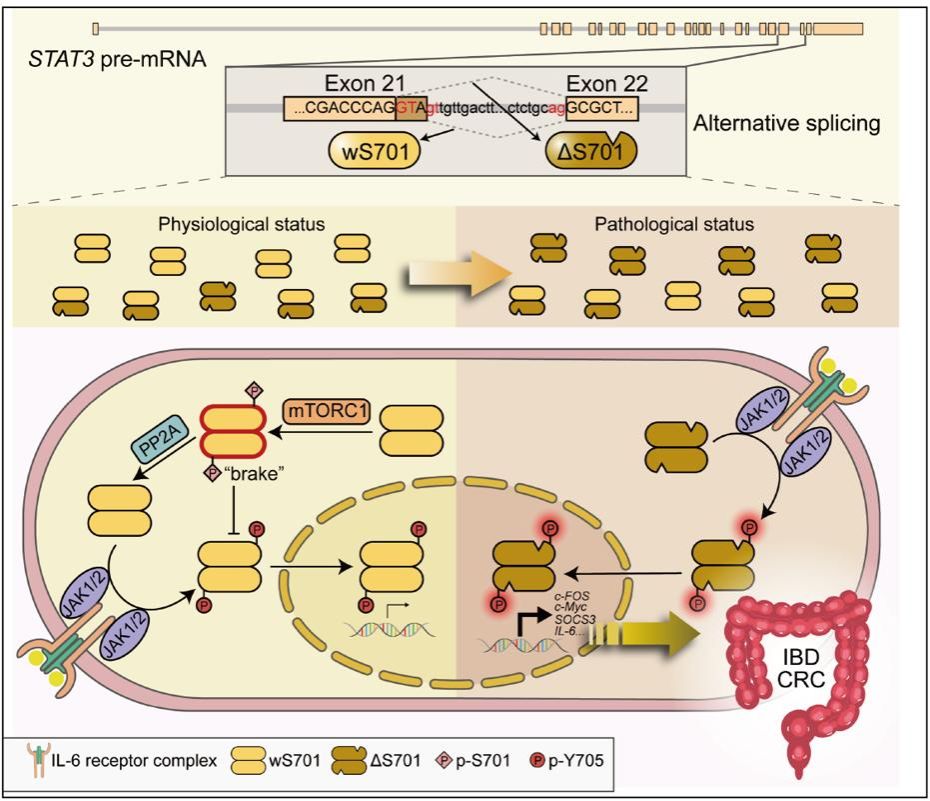
由隐含剪接产生的STAT3两种亚型对结肠炎相关肿瘤发生的调控机制示意图
这项研究首次揭示了“由可变剪接导致的单个氨基酸差异”对STAT3功能的决定性影响——通过一个精巧的“前馈刹车”机制,深刻改写了对结肠炎症-肿瘤转化的认知。未来,针对STAT3不同亚型的特异性诊断工具与靶向药物开发,有望为IBD与CRC患者带来新的治疗希望。
该项研究得到国家自然科学基金、湖北省人才工程项目、国家重点研发计划、中国医学科学院医学科学创新基金等项目的大力支持。
Science Translational Medicine创刊于2009年,由美国科学促进会出版,是《Science》重要子刊之一,专注于推动基础医学研究与临床应用的交叉融合。作为转化医学领域的顶级期刊,5年影响因子16.9(JCR Q1),2025年中科院分区为医学大类1区Top,自引率0.6%,录用率4.3%,在“医学研究与实验”领域排名全球第二。期刊年发文量约300篇,覆盖心血管疾病、肿瘤免疫,尤其强调跨学科研究创新性。
(审读人:万翠红 段治国 张晓骏)